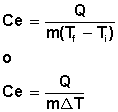TERMODINÁMICA:
También es conocida como el movimiento del calor, en esta rama de la física se estudia la transferencia de calor en trabajo mecánico y viceversa. su principal base es la conservación de la energía.
Nos proporciona una teoría básica que nos sirve para entender y poder diseñar maquinas térmicas (refrigeradores, cohetes, etc.).
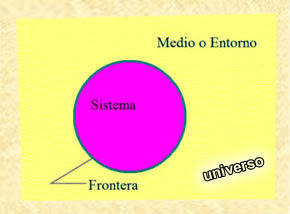
SISTEMA TERMODINAMICO:
Es una parte del universo que se separa con la finalidad poderla estudiar. Para ello se aísla de los alrededores a través de límites o fronteras, de tal manera que todo lo que se encuentra fuera de lo delimitado se denomina alrededores.
a) Frontera:
Es el limite que separa al sistema de lo alrededores, casi siempre son paredes que pueden ser diatérmicas o adiabáticas.
b) Pared diatérmicas:
Es una conductora de calor, ésta permite el intercambio de calor entre el sistema y sus alrededores y al revés.
c) Pared adiabática:
Es caracterizada por NO permitir la interacción térmica del sistema con los alrededores. Es construida de materiales no conductores del calor como porcelana o asbesto.
d) Equilibrio termodinámico:
Se alcanza cuando después de cierto tiempo de poner en contacto un sistema de baja temperatura con otro sistema a mayor temperatura se iguala, por lo tanto existe un intercambio de calor, las propiedades de presión, densidad y temperatura cuando se encuentran en este punto dejan de variar.
e) Energía interna ( Ei):
Es la energía contenida en el interior de las sustancias. Es la suma de energía cinética y potencial de las moléculas individuales que la forman. La mayoría de las veces se cumple cuanto mayor sea la temperatura de un sistema también lo será su energía interna.
La energía interna se hace presente en las sustancias combustibles y es proporcional a la masa.
EQUIVALENTE MECANICO DEL CALOR:
Fue establecido por un físico ingles llamado James Prescott Joule (1818-1889), es autor de importantes trabajos sobre la TEORIA MECANICA DEL CALOR, a mediados del sigo XIX. Demostró que cierta variación de temperatura indica un cambio de energía interna y aparece que se pierde determinada cantidad de energía molecular.
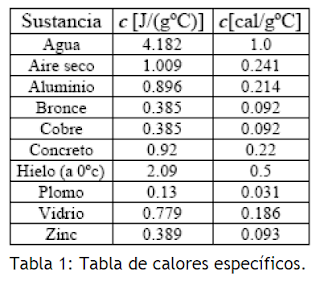
Después de varios experimentos en los cuales todos los resultados le daban 1J = 0.24 cal o 1 cal = 4.2J, concluyo que la energía mecánica y la energía que causaba la diferencia de temperatura eran equivalentes.
2.1.2 PRIMERA LEY DE LA TERMODINAMICA.
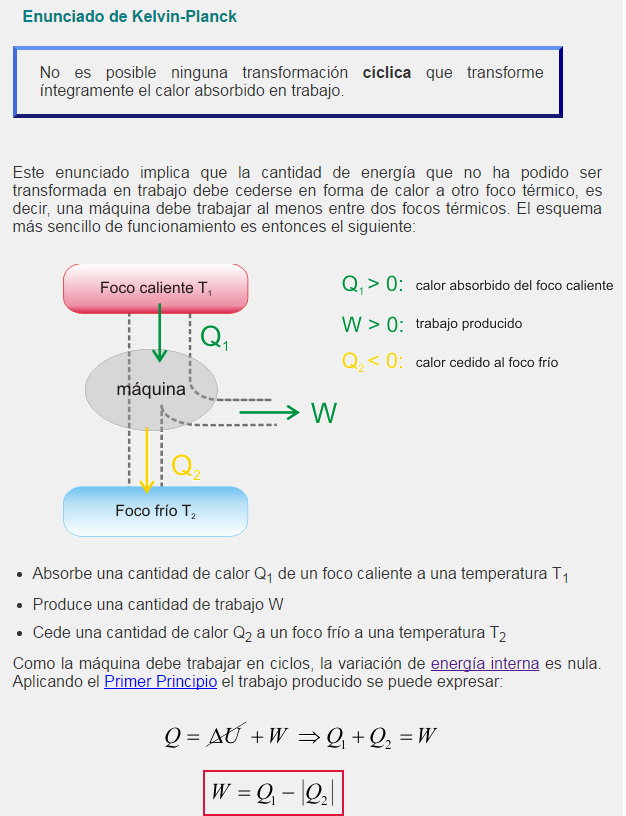
Esta ley dice que la variación de la energía interna de un sistema es igual a la energía que transfieren o reciben los alrededores en forma de calor y trabajo, de forma tal que se cumple la energía no se crea ni se destruye, solo se transforma.
La primera ley de la termodinámica se muestra matemáticamente de la siguiente manera:
a) Peso termodinámico:
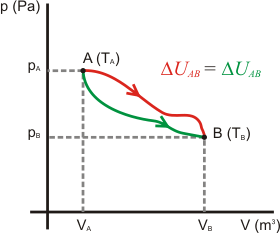
Es cuando la temperatura, presión o volumen de un gas varían. Los procesos termodinámicos se clasifican en:
PROCESO ISOTERMICO:
Se presenta cuando la temperatura del sistema, permanece constante independientemente de los cambio de presión o volumen que sufran.
Este proceso se rige por la ley de Boyle-Mariotte de Robert Boyle (1626-1691), Físico Químico irlandés conocido por sus experimentos acerca de las propiedades de los gases
y Edme Mariotte (1620-1684), Físico Francés que descubrió la ley que relación la presión y el volumen de los gases a temperatura constante.
Si un proceso isotérmico formado por un gas experimenta una expansión isotérmica, para que la temperatura permanezca constante la cantidad de calor recibido debe ser igual al trabajo que realiza durante la expansión. Pero si presenta una compresión isotérmica, para que la temperatura también permanezca constante el gas tiene que liberar una cantidad de calor igual al trabajo desarrollado sobre él.
La temperatura no cambia, su energía interna (Ei), son constantes y su variación de energía interna (ΔEi) es igual a cero, por lo que se cumple que (Ei es constante) (ΔEi = 0 ) Q=Tr.
PROCESO ISOBARICO:
Es cuando hay una variación del volumen o temperatura y la presión permanece constante, no importando si el gas sufre una compresión o una expansión. Este proceso rige por la Ley de Charles: Jackes A. Charles ( 1742-1822). Químico, físico y aeronauta Frances, que fue el primero en hacer mediciones acerca de los gases que se expanden al aumentar la temperatura.
Las ecuaciones para el proceso isobárico son:
PROCESO ISOCORICO:
Se presenta cuando el volumen del sistema permanece constante. Ya que la variación del volumen es cero, no se realiza trabajo sobre el sistema ni de éste último de sobre los alrededores, por lo que se cumple Tr = 0 Y ΔEi = Q, esto indica que todo el calor suministrado aumentara en la misma proporción a la energía interna, en general esto se presenta cuando un gas se calienta dentro de un recipiente con volumen fijo.
Cuando se calientan dos masas iguales de gas, a una presión constante y otra a volumen constante, para que logren el mismo incremento de temperatura se requiere proporcionar mayor calor al sistema a presión constante (Qp>Qv). Ello se debe a que en el proceso isobárico el calor suministrado se usa para aumentar la energía interna y efectuar trabajo, mientras que en el proceso isocórico todo el calor se usa para incrementar exclusivamente la energía interna.
PROCESO ADIABATICO:
Ocurre cuando el sistema no crea ni recibe calor, cumpliéndose que (Q=0) y ΔEi = -Tr , aun cuando el gas puede presentar expansión o comprensión.
En resumen las condiciones que se tienen que cumplir para los procesos son termodinámicos son:
CALENTAMIENTO POR COMPRESION:
Si un gas sufre compresión rápida, disminuye su volumen, se produce calor y se incrementa la temperatura.